GCP
临床试验伦理工作流程
北京高博博仁医院伦理审查流程
伦理审查
立项通过后,项目获得《机构立项函》,可进行伦理递交。
一、 伦理初始审查:
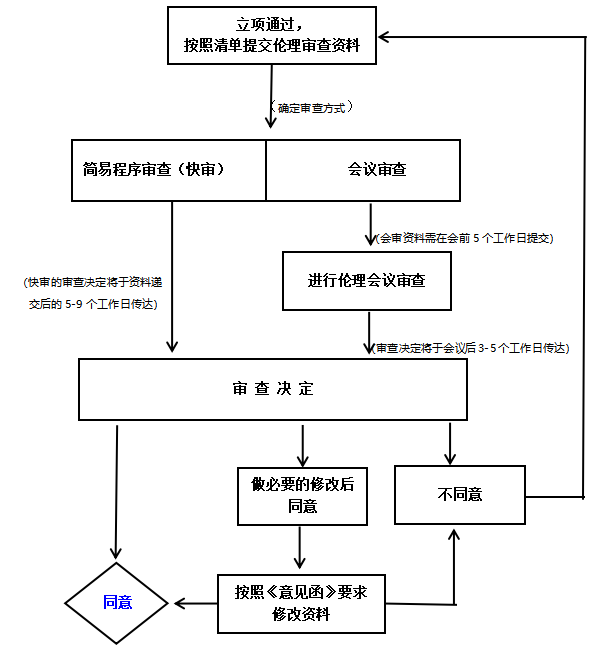
1. 立项通过,按照清单提交伦理审查资料:
1)下载文件包:
申办方/合作方/CRO/研究者下载附件中的相应文件包,以便准备开始递交资料至伦理办公室:药物注册类试验请下载“初始审查-药物注册类试验”文件包;IIT试验请下载“初始审查-IIT研究”文件包;
2)伦理形式审查:
①按照文件包中的“伦理初始审查送审文件清单”准备文件。将电子版文件(PDF格式)发送至伦理公共邮箱(bjbrgcpll@gobroadhealthcare.com),(CTMS上线后可通过系统上传资料)伦理办公室将于三个工作日内进行形式审查并回复意见。
②申办方/合作方/CRO/研究者按照形式审查的回复意见修改文件,并将修改后文件发送至伦理公共邮箱(或者通过CTMS系统上传)。
③形式审查通过,伦理办公室回复邮件通知。
3)递交纸质版资料:
申办方/合作方/CRO/研究者于伦理会议前至少5个工作日递交一份全套纸质版资料至伦理办公室;伦理办公室分配本院伦理项目受理号。
2. 伦理审查:
1) 确定审查方式:
伦理办公室根据递交的资料确定审查方式,包括:简易程序审查(快审)和会议审查。
2) 会议审查要求:
①如果项目确定为会议审查,主要研究者必须参会(会议答辩可由本项目其他研究者代答,但是PI必须参会)。
②申办方/合作方/CRO/研究者于会前2个工作日将定稿答辩PPT电子版发送至伦理公共邮箱,PPT模板请见附件文件包内。
③申办方/合作方/CRO/研究者于会前2个工作日将13套简版纸质文件送至伦理办公室;简版资料包括但不限于初始审查申请表/方案摘要/知情同意书/招募材料/其他提供给受试者的资料料/保单等,每份文件中间用隔页纸隔开,送审材料13套,可以装订,也可以用燕尾夹夹好13套。
3) 审查决定:
①简易程序审查(快审)的审查决定将于资料受理后的5-9个工作日内传达给申办方/合作方/CRO/研究者。
②会议审查的审查决定将于伦理会议后的3-5个工作日内传达给申办方/合作方/CRO/研究者。
3. 关于伦理前置审查:
药物注册临床试验尚未取得国家局批件的项目可以先递交CDE受理的相关文件,先在本院进行伦理审查。伦理批件需要取得国家局批件后发放。
二、 再审审查(复审):
伦理会议后,按伦理审查意见“修改后批准”和“修改后再审”,对方案或其他文件进行修改后,以“再审申请”的方式再次送审。填写文件包中的《再审审查申请表》,并将修改后文件以及修改对比摘要一并递交。
三、 伦理跟踪审查:
1. 伦理跟踪审查类型:
修正案审查、年度/定期跟踪审查、安全性事件审查、偏离方案审查、暂停/终止研究审查。申办方/合作方/CRO/研究者下载附件中的“跟踪审查申请表”文件包。
2. 伦理跟踪审查:
1) 修正案审查:
所有经伦理委员会审查同意的研究方案、知情同意书和招募广告以及其它提供给受试者的资料如有变更都须在实施前报告给伦理委员会,填写文件包中的《修正案审查申请表》,并将修改后文件以及修改对比摘要一并递交。
2) 年度/定期跟踪审查:
定期审查:年度内的定期审查可以在期限外一个月内递交。
年度审查:需要在批件有效期到期前一个月内递交。
(例如,某项目伦理批准日期为2022年12月2日,跟踪审查频率为6个月,批件有效期至2023年12月1日。那么此项目的定期审查应于6个月后的一个月内递交,也就是2023年6月2日至2023年7月2之间递交;此项目的年度审查应于2023年12月1日前一个月内递交。)
递交《年度/定期跟踪审查申请表》,并根据需要附上安全性事件列表及偏离列表。
3) 安全性事件审查:
SAE和SUSAR的递交请严格按照国家有关的规定和时限递交。
递交《安全性事件审查申请表》。
4) 偏离方案审查:
递交《偏离方案审查申请表》。
5) 暂停/终止研究审查:
试验在暂停/终止前,需要向伦理委员会递交《暂停/终止研究审查申请表》并获得批准后方可暂停/终止。
6) 结题审查:
结题审查需要向伦理委员会递交《结题审查申请表》和《结题报告》(可用申办者的模板)。
3. 伦理跟踪审查决定的传达
跟踪审查的审查决定将于受理后的3-5个工作日传达给申办方/合作方/CRO/研究者。
四、 伦理审查费用:
1. 初始审查:根据我院药物临床试验伦理委员会伦理审查费收取标准,初始审查应缴纳伦理审查费6000元、税费360元,共计6360元( 大写:陆仟叁佰陆拾元 )。
2. 修正案审查:根据我院药物临床试验伦理委员会伦理审查费收取标准,修正案审查应缴纳伦理审查费3000元、税费180元,共计3180元( 大写:叁仟壹佰捌拾元)。
3. 需要上会的其他跟踪审查:根据我院药物临床试验伦理委员会伦理审查费收取标准,需要上会的其他跟踪审查 应缴纳伦理审查费2000元、税费120元,共计2120元( 大写:贰仟壹佰贰拾元)。
4. 注意事项:伦理委员会经费独立管理,请提示贵司财务,伦理委员会收款账号和立项费收款账号不同,仅户名相同。需要付款时伦理办公室会出具《缴费单》,请按照伦理《缴费单》中的收款账号打款。
5. 打款后附上打款凭证和开票信息邮件发送伦理委员会邮箱
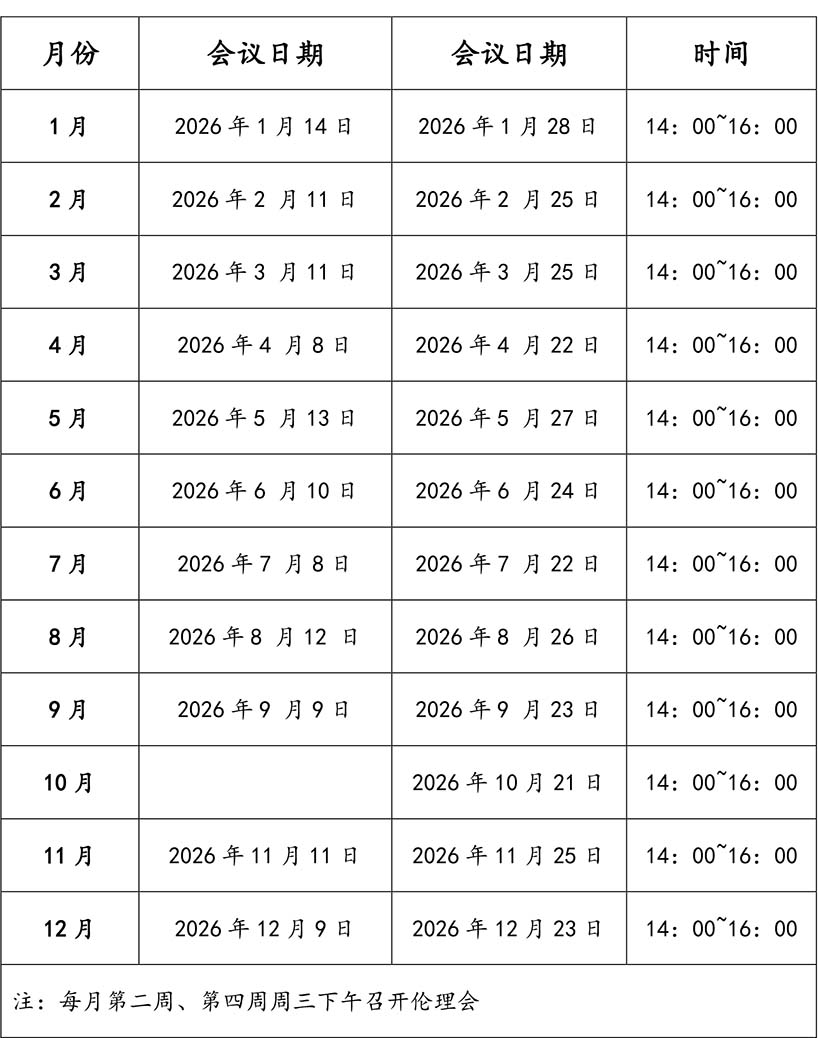
五、 北京高博博仁医院伦理委员会2026年会议时间表
六、 联系方式:
联系电话:010-83605002-502,联系人:鲁瑶
公共邮箱:bjbrgcpll@gobroadhealthcare.com
七、 附件
- 标签:
上一篇: 药物临床试验机构工作流程
下一篇: IIT管理工作流程




 京公网安备11010602050084号
京公网安备11010602050084号

